Co to jest stan gazowy:
Stan gazowy to stan materii składający się z atomów i molekuł zgrupowanych razem z niewielką siłą przyciągania do siebie lub rozszerzania się, co oznacza, że nie mogą się one w pełni zjednoczyć.
Materia w stanie gazowym nazywana jest gazem. Słowo gaz wywodzi się z łacińskiego chaos oznaczającego „chaos”. Zostało ono ukute przez chemika Jana Baptystę van Helmonta w XVII wieku.
Stan gazowy jest obok stanu ciekłego, stałego, plazmy i stanu Bose-Einstein'a jednym z całościowych stanów skupienia materii.
 Woda paruje lub gotuje się.
Woda paruje lub gotuje się.
Niektóre przykłady materii gazowej to:
- gaz tlenowy (O2);
- gazowy dwutlenek węgla (CO2);
- gaz ziemny (używany jako paliwo);
- gazy szlachetne takie jak hel (He); argon (Ar); neon (Ne); krypton (Kr); ksenon (Xe), radon (Rn) i oganeson (Og).
- azot (N2);
- para wodna.
Woda jest jedynym pierwiastkiem, który występuje naturalnie we wszystkich stanach skupienia materii (stały, ciekły i gazowy).
Cechy charakterystyczne stanu gazowego
 Różne gazy w ich pojemnikach.
Różne gazy w ich pojemnikach.
W stanie gazowym energia rozdzielenia pomiędzy molekułami i atomami przewyższa siłę przyciągania pomiędzy nimi, co powoduje szereg cech lub właściwości gazów.
- Gazy zawierają mniej cząsteczek niż ciecze i ciała stałe.
- Cząstki są od siebie oddalone, więc oddziaływanie między nimi jest niewielkie.
- Gazy nie mają określonego kształtu ani objętości.
- Kiedy dochodzi do zderzeń między cząsteczkami, zmieniają one chaotycznie kierunek i prędkość, co zwiększa ich odległość i objętość gazu.
- Gazy mogą zostać skompresowane do kształtu swojego pojemnika.
Cząsteczki są w ciągłym, nieuporządkowanym ruchu.
(tixagag_4) Większość gazów jest niematerialna, bezbarwna i bez smaku.
Gazy mogą zajmować całą dostępną dla nich objętość.
Zmiany stanu skupienia materii gazowej
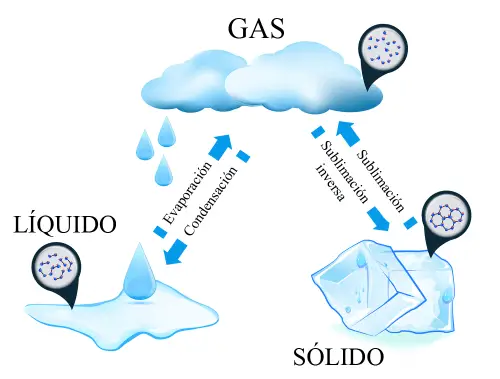 Zmiany stanu skupienia materii gazowej. Proszę zwrócić uwagę również na rozdział między cząsteczkami w zależności od stanu materii.
Zmiany stanu skupienia materii gazowej. Proszę zwrócić uwagę również na rozdział między cząsteczkami w zależności od stanu materii.
W zależności od zmiennych temperatury i ciśnienia mogą być generowane procesy przemiany materii z jednego stanu skupienia do drugiego. Przemiany materii w stanie gazowym są następujące:
Kondensacja lub skraplanie
Jest to przejście ze stanu gazowego do stanu ciekłego. Powstaje, gdy gaz poddany jest obniżeniu temperatury, co zmniejsza ruch cząsteczek i powoduje ich kurczenie się aż do stanu ciekłego. Możemy wskazać na dwa codzienne przykłady z wodą: 1) kiedy chmury przekształcają się w opady. 2) gdy szklanka z zimnym napojem wytwarza na zewnątrz kropelki wody poprzez skraplanie się gorącego powietrza w atmosferze.
Odparowanie lub wrzenie
Jest to przejście ze stanu ciekłego do stanu gazowego.Występuje, gdy ciecz jest poddawana wzrostowi temperatury aż do osiągnięcia punktu wrzenia. Przykładem jest, gdy woda gotuje się w rondlu aż do wyparowania.
Sublimacja
Sublimacja to przejście ze stanu stałego do stanu gazowego bez konieczności przechodzenia przez stan ciekły. Sublimacja następuje w wyniku tak ekstremalnych temperatur, że nie pozwalają one na tworzenie się cieczy. Przykładem sublimacji może być suchy lód, który uwalnia się w postaci pary bez przechodzenia przez stan ciekły.
Odwrotna sublimacja lub osadzanie
Jest to przejście ze stanu stałego do stanu gazowego bez konieczności przechodzenia przez stan ciekły. Przykładem odwrotnej sublimacji jest tworzenie się szronu na ziemi.
Czynniki wpływające na gazy
 Kiedy powietrze (gaz) wewnątrz balonu jest ogrzewane, zwiększa swoją objętość i dlatego unosi się do góry.
Kiedy powietrze (gaz) wewnątrz balonu jest ogrzewane, zwiększa swoją objętość i dlatego unosi się do góry.
Na zachowanie gazów mają wpływ następujące zmienne:
- Objętość (V): to przestrzeń zajmowana przez materię gazową, która jest mierzona w litrach (L). Gaz będzie miał większą lub mniejszą objętość w zależności od separacji pomiędzy cząsteczkami i dostępnej przestrzeni do rozprężenia.
(tixagag_4) Ciśnienie (P): jest siłą przyłożoną na powierzchnię. Ciśnienie pochodzi od ciężaru powietrza, więc im wyżej gaz się wznosi, tym mniejsze jest jego ciśnienie z powodu mniejszej ilości powietrza. W przypadku gazów, ciśnienie mierzone jest w atmosferach (atm).
(tixagag_4) Temperatura (T): jest miarą energii kinetycznej wytwarzanej między cząsteczkami gazu, która jest mierzona w jednostkach kelwinów (K). Jeśli zimne ciało materii zbliży się do gorącego ciała, to zimne ciało podniesie swoją temperaturę.
Te czynniki są z kolei związane z innymi elementami właściwymi dla gazów, takimi jak:
- Ilość: jest ilością masy substancji gazowej i jest mierzona w molach (n).
- Gęstość: odnosi się do stosunku objętości do wagi.
Patrz również:
- Stany skupienia materii.
- Kondensacja
- Odparowanie
Prawa gazowe lub prawa stanu gazu
Prawa gazowe są modelami interpretacyjnymi, które opisują związek pomiędzy różnymi zmiennymi, które wpływają na zachowanie gazów (temperatura, ciśnienie, ilość i objętość). Istnieją cztery prawa gazowe, z których każde koncentruje się na innych aspektach gazów. Są one znane jako:
Prawo Boyle'a: zajmuje się związkiem między ciśnieniem a objętością.
Z połączenia tych czterech praw powstaje prawo gazu doskonałego.
Prawo gazu idealnego
Gazy idealne to gazy, których cząsteczki nie wykazują ani przyciągania, ani odpychania, tzn. nie ma przyciągających sił międzycząsteczkowych. Gazy idealne są tak nazywane, ponieważ są one w rzeczywistości teoretycznym założeniem.
Prawo gazu idealnego przedstawia się następującym wzorem:
PV = nRT = NkT
gdzie:
- P: ciśnienie
- V: objętość
- n: liczba moli
- R: uniwersalna stała gazowa (8,3145 Jmol k)
- N: liczba molekuł
- k: Stała Boltzmanna (8,617385 x 10-5eVk)
T: temperatura
Prawo gazu doskonałego odnosi się do ciśnienia, objętości, temperatury i masy gazu w tym samym czasie w warunkach standardowych.