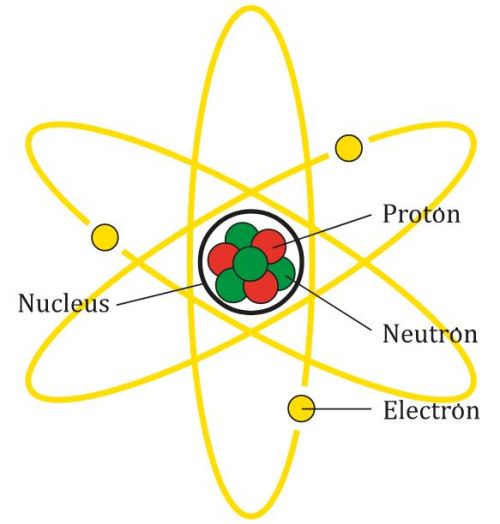
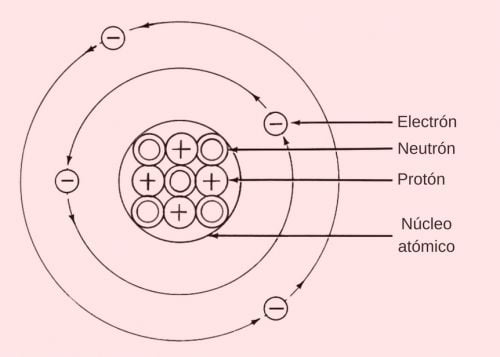
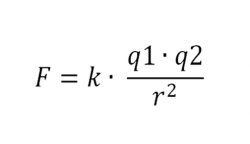Co to jest wiązanie jonowe
Wiązanie jonowe (zwane również wiązaniem elektrowalencyjnym) jest rodzajem wiązania chemicznego, które powstaje, gdy jeden atom oddaje elektron drugiemu, aby oba osiągnęły stabilność elektronową.
Wiązanie to występuje zazwyczaj pomiędzy metalami i niemetalami o różnej elektroujemności, co oznacza, że elementy te mają różną zdolność przyciągania elektronów. Ogólnie rzecz biorąc, pierwiastki metaliczne są skłonne oddać elektron, podczas gdy niemetale są skłonne przyjąć elektron.
Nazywa się je wiązaniami jonowymi, ponieważ w procesie tym powstają jony. Zobaczmy: kiedy dochodzi do przeniesienia elektronów pomiędzy atomami, donor staje się dodatnim jonem zwanym kationem, co oznacza, że nabywa dodatni ładunek. Z drugiej strony akceptor staje się jonem ujemnym zwanym anionem.
Wiązania jonowe są jednym z trzech rodzajów istniejących wiązań chemicznych, obok wiązań kowalencyjnych i metalicznych. Wiązania jonowe są najczęstszymi wiązaniami, które biorą udział w tworzeniu związków nieorganicznych.
Cechy charakterystyczne wiązań jonowych
Cechy charakterystyczne wiązań jonowych odnoszą się do pierwiastków biorących w nich udział, procesu wiązania i jego wyniku.
- Występują one pomiędzy pierwiastkami metalicznymi (grupa I i II) i niemetalami (grupa VI i VII) układu okresowego.
- Atomy, które je tworzą, muszą mieć między sobą różnice w elektroujemności.
- Są one produktem transferu elektronów.
- Ich atomy po przeniesieniu elektronów przekształcają się w kationy i aniony, w wyniku czego powstaje wiązanie.
- Są to silne, ale sztywne wiązania, dzięki przyciąganiu się ładunków ujemnych i dodatnich.
Właściwości wiązania jonowego
Związki tworzone przez wiązania jonowe wykazują szereg właściwości, które wynikają z silnego przyciągania ładunków w tych wiązaniach i determinują ich zachowanie chemiczne. Mianowicie.
-
(tixagag_4) Są neutralne w stanie stałym: kiedy są w stanie stałym, ładunek elektryczny wiązań jonowych jest neutralny.
- Zazwyczaj się krystalizują: ze względu na trójwymiarową strukturę wiązania jonowego, sprzyjają one kruchym sieciom krystalicznym.
- Wysokie temperatury wrzenia i topnienia (300º C do 1000º C): Ponieważ między jonami istnieje bardzo silna siła przyciągania, muszą one przejść przez wysokie temperatury topnienia lub wrzenia, aby zmienić swój stan skupienia.
- Ciała stałe w temperaturach pomiędzy 20º C a 30º C: w konsekwencji powyższego, wiązania jonowe są z reguły stałe w temperaturze pokojowej.
- Dobre przewodniki prądu: Wiązania jonowe są dobrymi przewodnikami prądu, o ile są rozpuszczone w wodzie.
Jak powstaje wiązanie jonowe
Kiedy pierwiastek metaliczny i pierwiastek niemetaliczny zbliżają się do siebie, dążą do stabilności elektronicznej. Metal będzie skłonny oddać elektron walencyjny ze swojej najbardziej zewnętrznej powłoki, podczas gdy niemetal będzie skłonny przyjąć ten elektron w swojej najbardziej zewnętrznej powłoce.
Gdy pierwiastek metaliczny przeniesie swój elektron, uzyskuje on ładunek dodatni, czyli staje się kationem (jonem dodatnim). Niemetal natomiast otrzymuje ładunek ujemny, kiedy otrzymuje elektron i staje się w ten sposób anionem (jonem ujemnym).
Dodatnie i ujemne ładunki jonów natychmiast wytwarzają siłę przyciągania, która je ze sobą łączy. W ten sposób powstaje wiązanie jonowe.
Proces tworzenia wiązania jonowego
Na przykład , sód (Na) ma jeden elektron walencyjny w ostatniej powłoce elektronowej, podczas gdy chlor (Cl) ma ich siedem.Kiedy sód i chlor zbliżają się do siebie, sód oddaje swój elektron chlorowi. Chlor zyskuje wtedy 8 elektronów walencyjnych.
Kiedy sód traci swój elektron, zyskuje ładunek dodatni i staje się kationem.Kiedy chlor zyskuje elektron, staje się ujemny i staje się anionem.
Ponieważ ładunki dodatnie i ujemne przyciągają się, oba jony łączą się ze sobą tworząc wiązanie jonowe. Tym szczególnym związkiem, powstałym z wiązań jonowych, jest chlorek sodu (NaCl), chemiczna nazwa soli kuchennej.
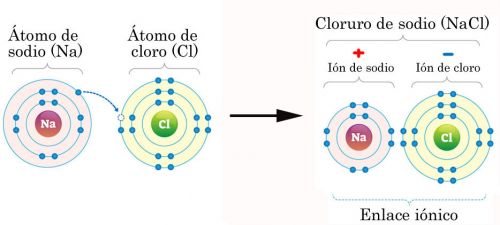 Przykład procesu tworzenia wiązania jonowego chlorku sodu (sól kuchenna).
Przykład procesu tworzenia wiązania jonowego chlorku sodu (sól kuchenna).
Patrz także: Ion
Przykłady wiązań jonowych
- Bromek potasu (KBr) , składnik leków homeopatycznych, środków uspokajających, przeciwdrgawkowych, moczopędnych itd.
- Węglan wapnia (CaCO3), zastosowanie w medycynie, między innymi jako środek zobojętniający, trawienny.
- Chlorek amonu (NH4Cl), baza nawozowa.
- Chlorek magnezu (MgCl2), którego właściwości obejmują bycie środkiem przeciw zamarzaniu.
- Chlorek manganu (MnCl2), stosowany w produkcji farb, lakierów, środków dezynfekujących itp.
- chlorek sodu (NaCl), zwykła sól kuchenna.
- dichromian potasu (K2Cr2O7), stosowany w produkcji pigmentów, obróbce skóry, obróbce metali itp.
- Fluorek litu (LiF), stosowany w produkcji szkła, kryształów, emalii i ceramiki.
- Fosforan disodowy (Na2HPO4), szeroko stosowany jako stabilizator do produktów mięsnych.
- Wodorotlenek potasu (KOH), stosowany w mydłach, detergentach, nawozach itp.
- Wodorotlenek cynku (Zn(OH)2), szeroko stosowany w leczeniu skóry, jak np. kremy i balsamy do opalania.
- Podchloryn sodu (NaClO), przydatny w dezynfekcji wody.
- Jodek potasu (KI), stosowany jako podstawa do soli jodowanej
- Azotan wapnia (Ca(NO3)2), stosowany w oczyszczaniu ścieków.
- Azotan srebra (AgNO3), pozwala na wykrycie chlorków w innych roztworach. Służy jako środek kauteryzujący przy różnych zmianach chorobowych.
- Tlenek wapnia (CaO), wapno.
- Tlenek żelaza II (FeO), baza do pigmentów kosmetycznych i barwników do ciała.
- Tlenek magnezu (MgO), środek przeczyszczający i środek zobojętniający, powszechnie znany jako mleko magnezowe.
- Siarczan miedzi (CuSO4), służy jako środek grzybobójczy, środek do czyszczenia basenów i składnik pasz dla zwierząt.
- Siarczan potasu (K2SO4), ma zastosowanie jako nawóz i jest składnikiem niektórych materiałów budowlanych.
Różnica między wiązaniami jonowymi a kowalencyjnymi
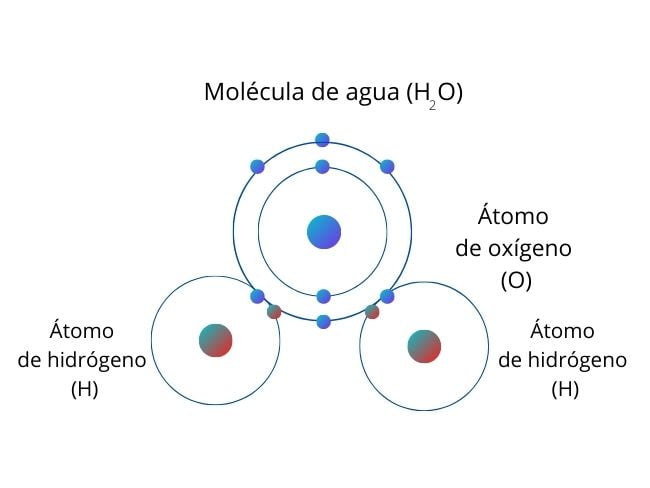
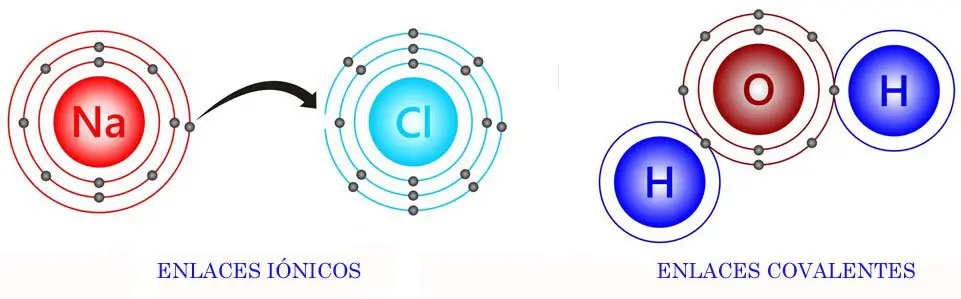 Po lewej stronie widzimy, jak sód (Na) przenosi elektron na cząsteczkę chloru, tworząc sól kuchenną (NaCl). Po prawej stronie widzimy cząsteczkę tlenu, która dzieli się parą elektronów z dwoma cząsteczkami wodoru, tworząc wodę (H2O).
Po lewej stronie widzimy, jak sód (Na) przenosi elektron na cząsteczkę chloru, tworząc sól kuchenną (NaCl). Po prawej stronie widzimy cząsteczkę tlenu, która dzieli się parą elektronów z dwoma cząsteczkami wodoru, tworząc wodę (H2O).
Najważniejsza różnica między wiązaniami jonowymi i kowalencyjnymi polega na tym, że wiązania jonowe przenoszą elektron z jednego atomu na drugi. Natomiast w wiązaniach kowalencyjnych atomy dzielą się parą elektronów.
Wiązania jonowe występują z reguły pomiędzy metalami i niemetalami. Wiązania kowalencyjne powstają tylko między pierwiastkami niemetalicznymi.
Kolejna różnica polega na rodzaju związków, które wytwarzają oba wiązania. Większość związków nieorganicznych składa się z wiązań jonowych. Związki organiczne natomiast są zawsze tworzone z wiązaniami kowalencyjnymi.
Może być Pan zainteresowany:
- Wiązanie kowalencyjne
- Związki nieorganiczne
- Związki organiczne
- Związki chemiczne