Co to jest wiązanie kowalencyjne?
Wiązanie kowalencyjne to siła, która łączy ze sobą dwa atomy pierwiastków niemetalicznych w cząsteczkę. Podstawą tego wiązania jest fakt, że atomy dzielą się parami elektronów w swojej najbardziej zewnętrznej powłoce (zwanej powłoką walencyjną), aby osiągnąć stabilność cząsteczki utworzonej przez wiązanie.
Tendencja pierwiastków do osiągnięcia stabilnej konfiguracji jest znana jako reguła oktetu i jest podstawą do tworzenia wiązań kowalencyjnych i innych rodzajów wiązań chemicznych (np. wiązań jonowych).
W zależności od zdolności atomów do przyciągania elektronów, wiązania kowalencyjne mogą być polarne lub niepolarne. Mogą być również pojedyncze, podwójne lub potrójne, w zależności od liczby elektronów, którymi się dzielą.
Cechy charakterystyczne wiązań kowalencyjnych
- Wiązania kowalencyjne są najbardziej stabilne, gdy są niepolarne, to znaczy, gdy elektronegatywność atomów jest podobna.
- Elektrony są zawsze dzielone parami, albo w wiązaniach pojedynczych, podwójnych (cztery elektrony) lub potrójnych (sześć elektronów).
Tworzą się one tylko między pierwiastkami niemetalicznymi (tlen (O), wodór (H), azot (N) itd.)
Rodzaje wiązań kowalencyjnych
Wiązania kowalencyjne są sklasyfikowane według elektroujemności wiążących się atomów i liczby elektronów, które są między nimi współdzielone.
Polarne wiązanie kowalencyjne
Cząsteczka składa się z więcej niż jednego atomu. Gdy jeden atom silniej przyciąga elektrony, w tej części molekuły powstaje większa koncentracja elektronów. To zjawisko nazywa się polaryzacją.
Część molekuły, w której skupiają się elektrony, ma ujemny ładunek cząstkowy, podczas gdy inny obszar molekuły ma dodatni ładunek cząstkowy.
Dlatego ten rodzaj wiązania nazywany jest „polarnym”, ponieważ następuje polaryzacja lub nierównomierne rozmieszczenie elektronów, które tworzą cząsteczkę.
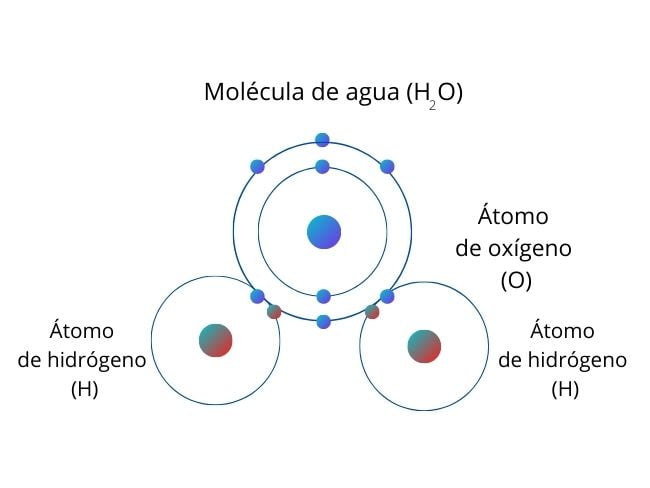
W cząsteczce wody (H2O) atom tlenu ma największą polaryzację, dlatego przyciąga elektrony od wodoru.
Niepolarne wiązanie kowalencyjne
Występuje wtedy, gdy pary elektronów są dzielone między atomy, które mają równą lub bardzo podobną elektroujemność. To sprzyja równomiernemu rozmieszczeniu elektronów.
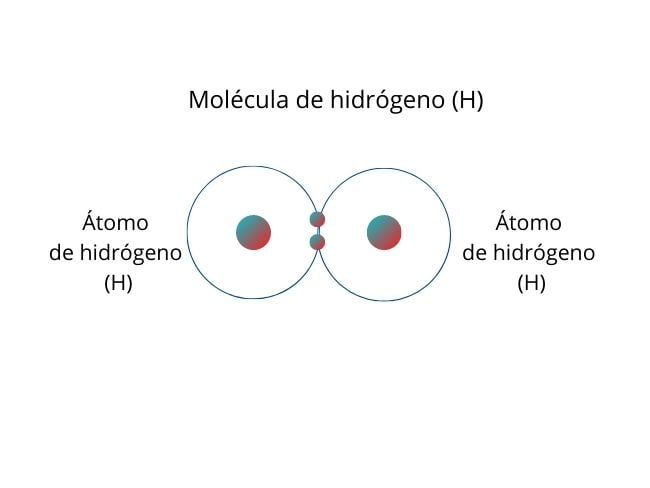
Cząsteczka wodoru (H), składająca się z dwóch atomów wodoru, jest przykładem niepolarnego wiązania kowalencyjnego.
Datywne lub skoordynowane wiązanie kowalencyjne
Ten typ wiązania jest tak nazwany, ponieważ tylko jeden z atomów w wiązaniu wnosi swoje elektrony. Ten atom nazywany jest atomem donorem, a atom, który otrzymuje elektrony, nazywany jest atomem akceptorem. Graficznie jest on oznaczony strzałką.
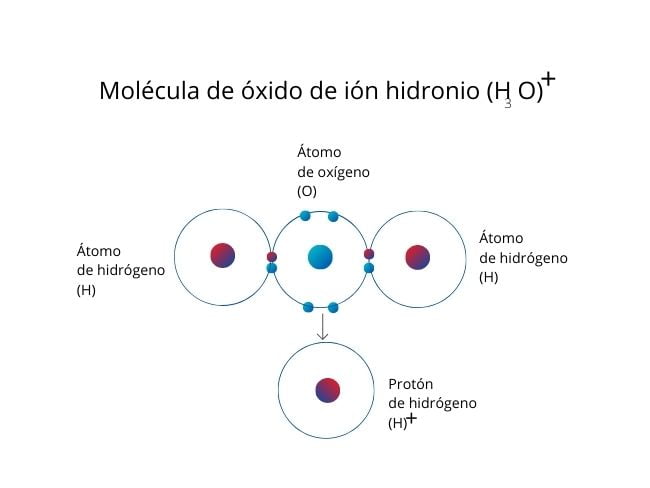
W cząsteczce jonu wodorowego lub jonu hydroniowego (H3O)⁺ tlen wnosi parę elektronów do jonu wodorowego (protonu).
Proste wiązanie kowalencyjne
Występuje, gdy każdy atom dzieli się jednym elektronem, aby uzupełnić parę elektronów w wiązaniu.
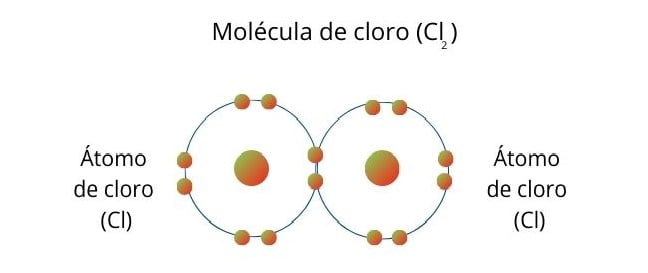
Cząsteczka chloru (Cl2) powstaje, gdy atomy dzielą się jednym elektronem, aby uzupełnić po 8 elektronów w swojej powłoce walencyjnej.
Podwójne wiązanie kowalencyjne
Wiązania podwójne powstają, gdy dwie pary elektronów są dzielone między dwa atomy, w sumie cztery wspólne elektrony.
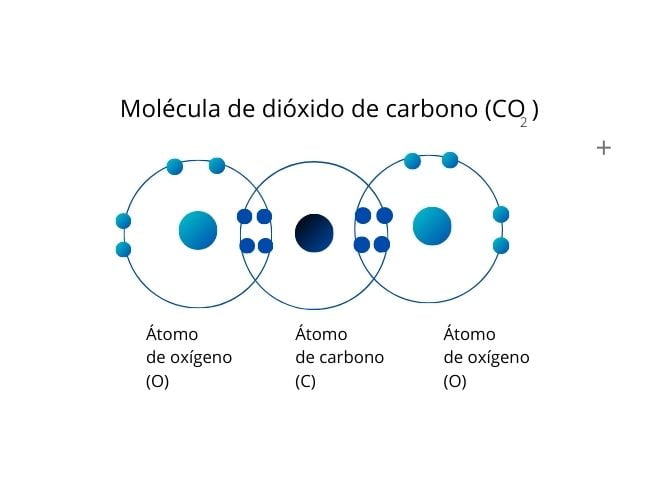
Przykładem jest dwutlenek węgla (CO2), którego atomy tlenu mają po parze elektronów z atomem węgla.
Potrójne wiązanie kowalencyjne
Gdy atomy dzielą się sześcioma elektronami (trzy pary), powstaje wiązanie potrójne.
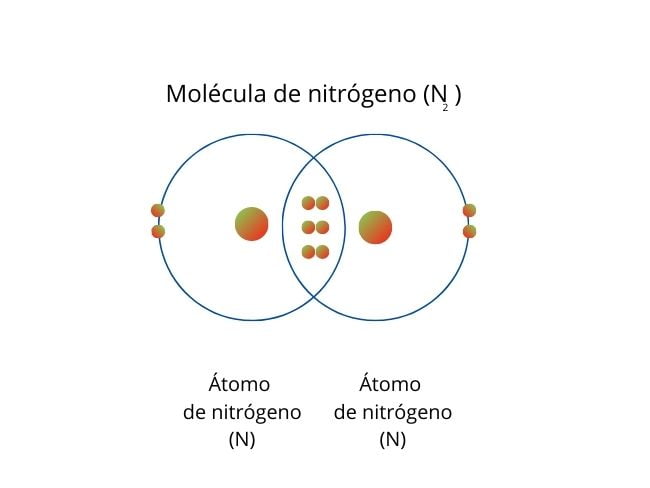
Przykładem jest molekuła azotu (N2), której atomy dzielą trzy pary elektronów.
Zasada oktetu w wiązaniach kowalencyjnych
Reguła oktetu jest znana jako tendencja niektórych pierwiastków w układzie okresowym do osiągnięcia stabilnej konfiguracji.
W rzeczywistości najbardziej stabilnymi atomami w układzie okresowym są gazy szlachetne, takie jak argon (Ar) lub neon (Ne), które posiadają 8 elektronów w swojej powłoce walencyjnej.
Inne atomy próbują osiągnąć stabilność gazów szlachetnych, reagując z innymi atomami, z którymi mogą dzielić się elektronami, aż osiągną 8.
Przykładem jest cząsteczka chloru (Cl), która składa się z dwóch atomów. Każdy z nich ma 7 elektronów, więc każdy atom dzieli się elektronem, aby drugi mógł uzyskać 8 elektronów.
Zasada oktetu ma wyjątki, ponieważ nie jest prawdziwa dla cząsteczek berylu (Be) i boru (B).
Znaczenie zasady oktetu polega na tym, że znając skłonność atomów do samodzielnego kształtowania struktury, można przewidzieć, jak będą się one zachowywać, gdy połączą się z innymi pierwiastkami.
Reguła ta została odkryta przez fizykochemika Gilberta Newtona Lewisa w 1916 roku.
Być może zainteresuje Pana lektura:
- Wiązanie jonowe
- Elektron
- Orbital atomowy
- Układ okresowy
Związki organiczne