Co to jest tablica okresowa pierwiastków?
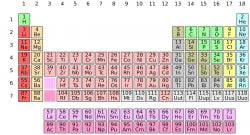
Układ okresowy, lub układ okresowy pierwiastków, jest uporządkowanym zapisem pierwiastków chemicznych według ich liczby atomowej, właściwości i cech.
Składa się z 118 pierwiastków potwierdzonych przez Międzynarodową Unię Chemii Czystej i Stosowanej (IUPAC), z których
- 94 są naturalnie występującymi pierwiastkami, oraz
- 24 pierwiastki są syntetyczne, tzn. zostały stworzone sztucznie.
Ich rozwój jest ściśle związany z odkrywaniem nowych pierwiastków i badaniem ich wspólnych właściwości. Aspekty takie jak pojęcie masy atomowej i związki między masą atomową a właściwościami okresowymi pierwiastków miały fundamentalne znaczenie dla ukształtowania nowoczesnego układu okresowego.
Układ okresowy funkcjonuje jako podstawowe narzędzie w nauce chemii, ponieważ umożliwia on spójną i łatwą identyfikację różnic i podobieństw pomiędzy pierwiastkami chemicznymi.
Jego stworzenie przypisuje się rosyjskiemu naukowcowi Dimitrowi Mendelejewowi w 1869 roku. Od tego czasu układ okresowy był ulepszany i aktualizowany przez innych naukowców, w miarę odkrywania i badania nowych pierwiastków.
Jak zorganizowany jest układ okresowy?
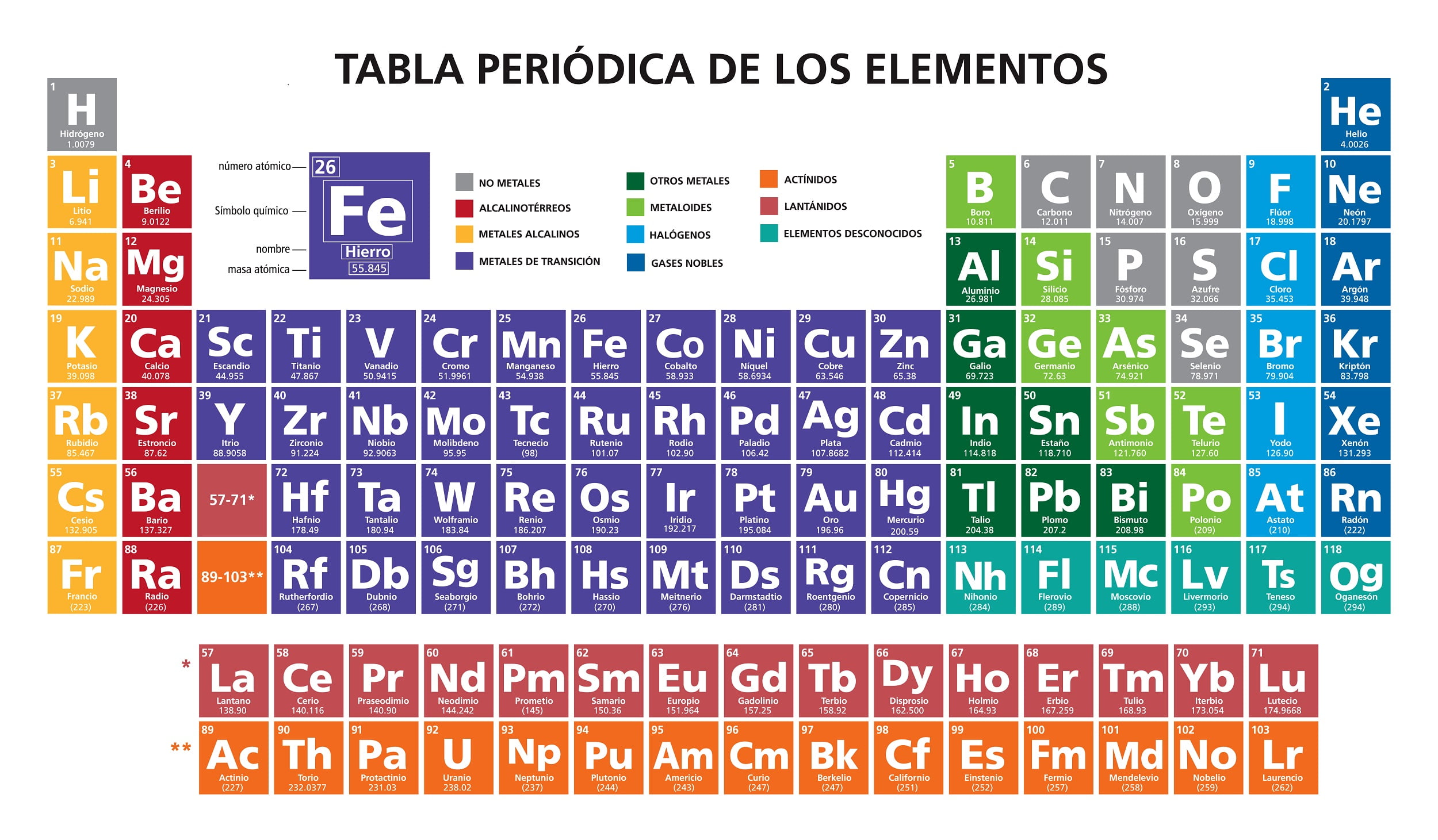
Układ okresowy przedstawia wszystkie znane dotychczas pierwiastki, które są uporządkowane i umieszczone według ich właściwości i wzajemnego stosunku do siebie w grupach, okresach, blokach budulcowych oraz metalach, metaloidach i niemetalach.
Grupy
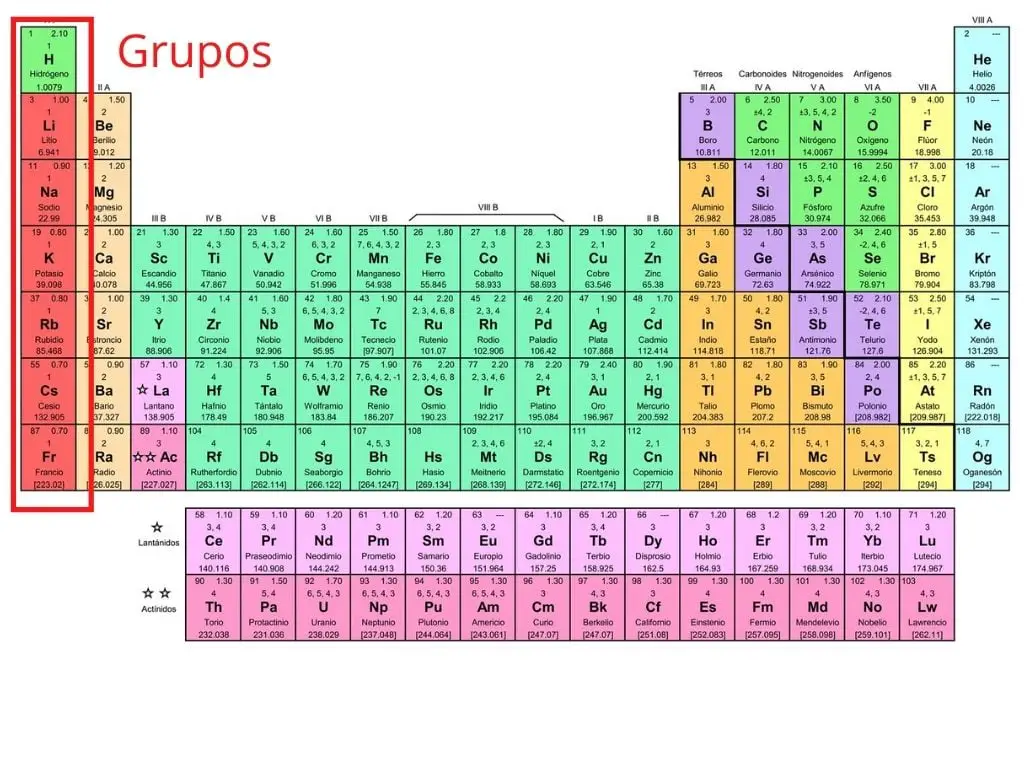
Układ okresowy składa się z 18 grup pierwiastków ułożonych w pionowych kolumnach, ponumerowanych od 1 do 18 od lewej do prawej, zaczynając od metali alkalicznych, a kończąc na gazach szlachetnych.
Pierwiastki, które należą do tej samej kolumny, mają podobne właściwości chemiczne na podstawie tego, jak zbudowane są elektrony w ostatniej powłoce atomu.
Na przykład pierwsza kolumna zawiera pierwiastki, które mają elektron w ostatniej powłoce atomu. W tym przypadku potas ma cztery powłoki i posiada jeden elektron w ostatniej z nich.
Pierwiastki chemiczne są zorganizowane w następujące grupy:
- Grupa 1 (I A): metale alkaliczne.
- Grupa 2 (II A): metale ziem alkalicznych.
- Grupa 4 (IV B): rodzina tytanów.
- Grupa 5 (V B): Rodzina wanadowa.
- Grupa 6 (VI B): rodzina chromu.
- Grupa 7 (VII B): Rodzina manganowa.
- Grupa 15 (V A): nitrogenoidy.
- Grupa 16 (VI A): chalcogeny lub amfogeny.
- Grupa 17 (VII A): halogeny.
Grupa 3 (III B): rodzina skandu.
Grupa 8 (VIII B): Rodzina żelaza.
Grupa 9 (VIII B): Rodzina kobaltowa.
Grupa 10 (VIII B): Rodzina niklu.
(tixagag_4) Grupa 11 (I B): Rodzina miedzi.
Grupa 12 (II B): Rodzina cynków.
Grupa 13 (III A): metale ziemne.
Grupa 14 (IV A): węgliki.
Grupa 18 (VIII A): Gazy szlachetne.
Okresy
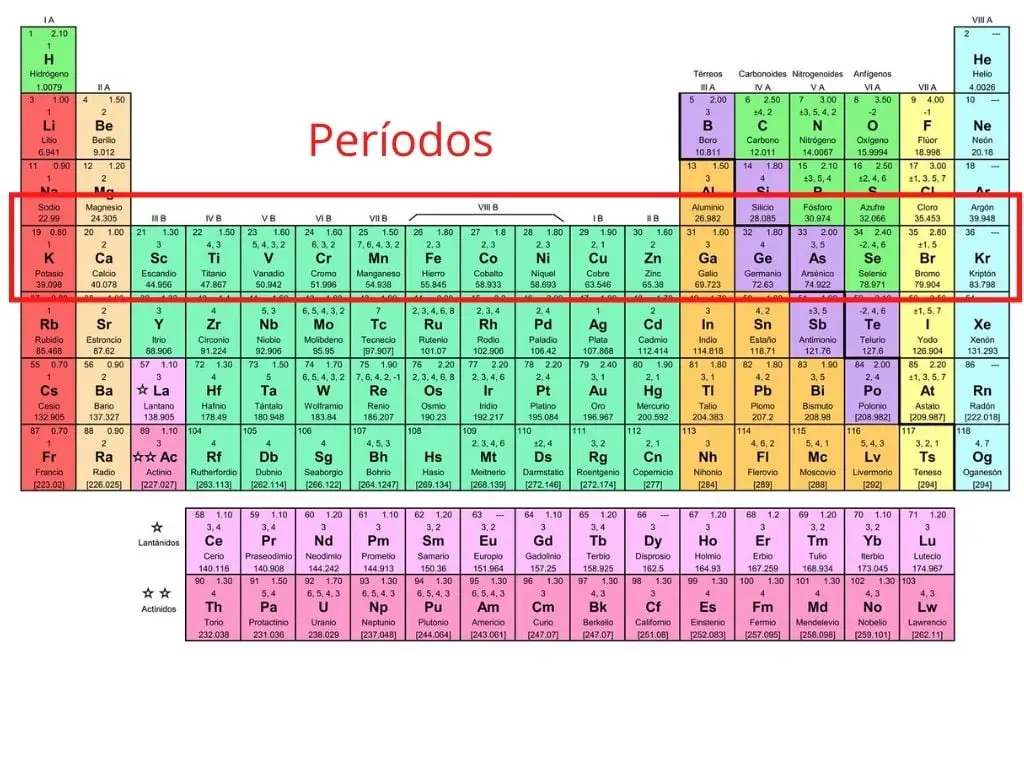
Okresy to siedem poziomych rzędów układu okresowego. W tych rzędach pogrupowane są pierwiastki, które mają liczbę powłok elektronowych odpowiadającą numerowi okresu.
Na przykład w pierwszym rzędzie wodór i hel mają jedną powłokę elektronową. W okresie drugim znajduje się osiem pierwiastków, które mają dwie powłoki elektronowe. W trzecim rzędzie pierwiastki mają trzy powłoki elektronowe i tak dalej.
W okresie szóstym znajdują się pierwiastki, które mają sześć powłok elektronowych, jak np. dolny rząd lantanowców. W okresie siódmym znajdują się pierwiastki, które mają siedem powłok elektronowych, jak np. dolny rząd aktynowców.
Metale, metaloidy i niemetale
W układzie okresowym można wyróżnić trzy kategorie pierwiastków na podstawie ich właściwości chemicznych i fizycznych: metale, metaloidy i niemetale.
- Metale: są w temperaturze pokojowej pierwiastkami stałymi, z wyjątkiem rtęci, która jest w stanie ciekłym. Są one plastyczne i ciągliwe, dobrze przewodzą ciepło i elektryczność. Znajdują się one po lewej stronie tabeli.
- Niemetale: przeważnie są to gazy, chociaż istnieją również ciecze. Te elementy nie są dobrymi przewodnikami prądu. Znajdują się one po prawej stronie stołu.
- Metaloidy lub półmetale: posiadają właściwości zarówno metali jak i niemetali. Mogą być błyszczące, nieprzezroczyste i niezbyt plastyczne. Ich przewodnictwo elektryczne jest niższe niż metali, ale wyższe niż niemetali. Znajdują się one po prawej stronie tabeli, pomiędzy metalami i niemetalami.
Bloki
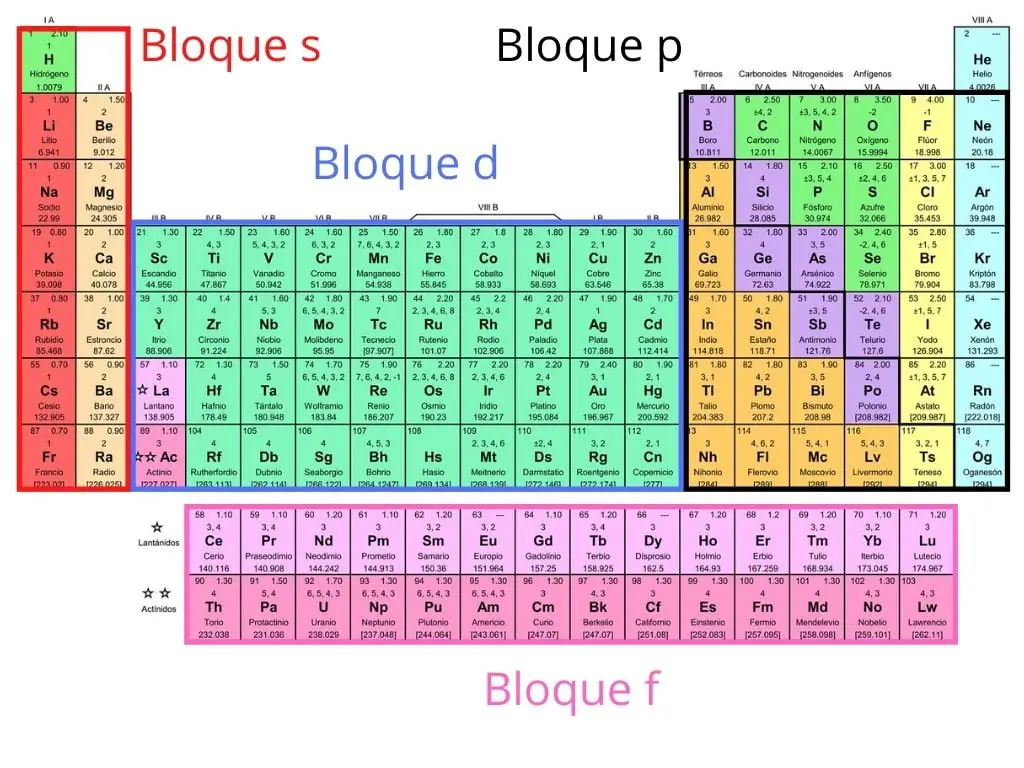
Układ okresowy można również podzielić na cztery bloki zgodnie z kolejnością powłok elektronowych każdego pierwiastka. Nazwa każdego bloku pochodzi od orbitalu, w którym znajduje się ostatni elektron.
- Blok s: grupa 1 i 2 metali alkalicznych, metale ziem alkalicznych, wodór i hel.
- Blok p: grupy 13 do 18 i metaloidy.
- Blok f: nie ma numeru grupy i odpowiada lantanowcom i aktynowcom. Zazwyczaj są one umieszczone poniżej układu okresowego.
Blok d: obejmujący grupy od 3 do 12 i metale przejściowe.
Trendy w układzie okresowym
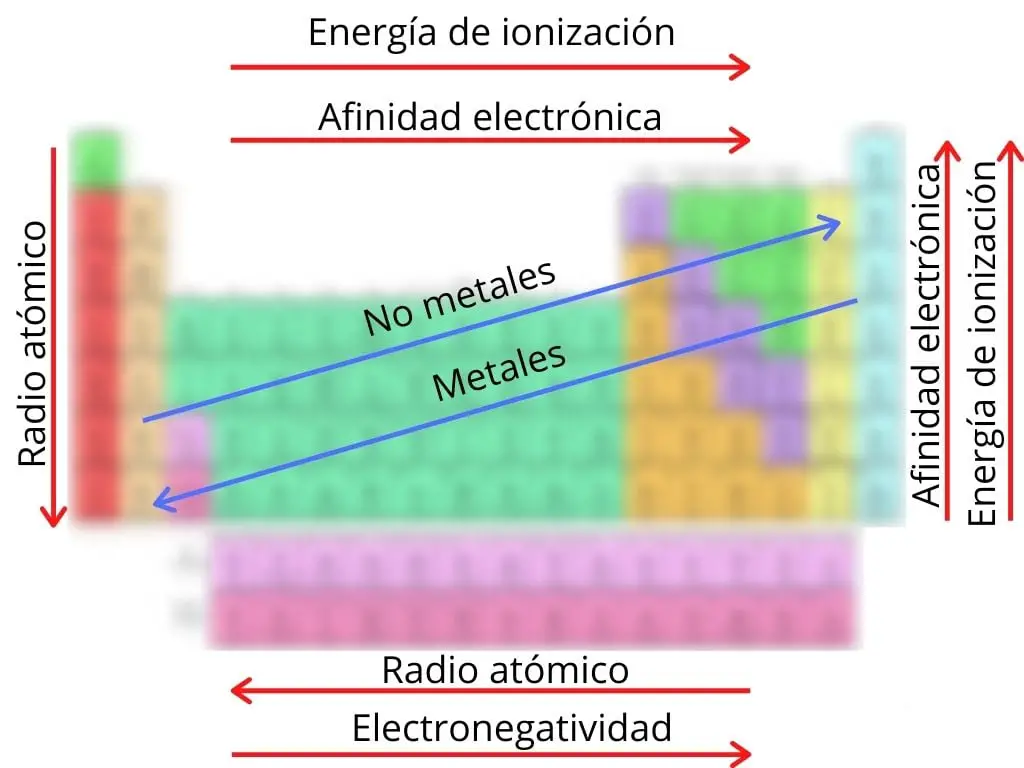 Układy okresowe odnoszą się do głównych właściwości fizycznych i chemicznych, które posiadają pierwiastki i które umożliwiają ich organizację w układzie okresowym. Te tendencje są związane ze zmianami, które zachodzą w strukturze atomowej każdego pierwiastka w zależności od okresu lub grupy, do której należy.
Układy okresowe odnoszą się do głównych właściwości fizycznych i chemicznych, które posiadają pierwiastki i które umożliwiają ich organizację w układzie okresowym. Te tendencje są związane ze zmianami, które zachodzą w strukturze atomowej każdego pierwiastka w zależności od okresu lub grupy, do której należy.
Do trendów okresowych należą:
-
(tixagag_4) Promień atomowy: to odległość między jądrem atomu a jego najbardziej zewnętrznym orbitalem, która pozwala nam obliczyć wielkość atomu. Wzrasta ona w okresach z prawej strony na lewą, a w grupach z góry na dół.
- Przynależność elektronowa : opisana jako energia uwalniana przez atom przy dodaniu elektronu lub odwrotnie. Wzrasta w okresach od lewej do prawej, a w grupach wzrasta w górę.
- Energia jonizacji: energia potrzebna do oddzielenia elektronu od atomu. W okresie energia ta wzrasta w prawo, a w grupie wzrasta w górę.
- Elektronegatywność: Zdolność atomu do przyciągania do siebie elektronów. Wzrasta ona w pewnym okresie od lewej do prawej.
- Niemetale: właściwości niemetali wzrastają wraz z przesuwaniem się pierwiastków do prawej górnej części tabeli.
- Metale: właściwości metali są większe, ponieważ pierwiastki te znajdują się w lewej dolnej części tabeli.
(tixagag_4) Elektrony walencyjne: odnosi się do elektronów w najbardziej zewnętrznej powłoce atomu. Rosną one wraz z rozmieszczeniem pierwiastków od lewej do prawej i są ustalane na podstawie grupy układu okresowego, do której należy dany pierwiastek.
Podstawowe fakty o pierwiastkach chemicznych
Układy okresowe zawierają zazwyczaj podstawowe dane każdego z pierwiastków w nim zawartych, co pozwala na stworzenie spójnej organizacji na podstawie ich cech charakterystycznych, takich jak symbol, nazwa, liczba atomowa i masa atomowa, w celu określenia ich zastosowania.

- Masa atomowa: odnosi się do masy atomu, składającego się z protonów i neutronów.
- Energia jonizacji: to energia, która jest potrzebna do oddzielenia elektronu od atomu.
- Nazwa: nazwa nadana pierwiastkowi chemicznemu, może pochodzić z łaciny, angielskiego, francuskiego, niemieckiego lub rosyjskiego.
- Konfiguracja elektroniczna: sposób, w jaki elektrony w atomie są zbudowane lub ułożone.
- Elektroujemność: to zdolność atomu do przyciągania do siebie elektronów.
- Stany utleniania: wskaźnik stopnia utlenienia atomu, który jest częścią złożonego pierwiastka chemicznego.
Symbol chemiczny: skrót do identyfikacji pierwiastka chemicznego.
Liczba atomowa: odnosi się do całkowitej liczby protonów, które posiada atom.
Do czego służy układ okresowy?
Układ okresowy jest bardzo przydatny w nauce ze względu na różne funkcje, które posiada.
- Dzięki temu możemy zidentyfikować różnice i podobieństwa pomiędzy poszczególnymi elementami. Na przykład, zawiera cenne informacje, takie jak masa atomowa każdego pierwiastka.
- Umożliwia analizę chemicznego zachowania się pierwiastków. Na przykład poprzez rozróżnienie elektronegatywności i konfiguracji elektronicznej pierwiastka.
- Służy jako podstawowe narzędzie do badania chemii, również biologii i innych gałęzi nauki, ponieważ identyfikuje główne cechy pierwiastków chemicznych.
- Dzięki temu można łatwo rozróżnić pierwiastki na podstawie ich liczby atomowej. Dzieje się tak, ponieważ pierwiastki składają się z atomów, które są nazywane i rozróżniane na podstawie liczby protonów, elektronów i neutronów, które zawierają.
- Za jego pomocą można przewidzieć właściwości chemiczne nowych pierwiastków, które mają być włączone do tabeli, z uwzględnieniem właściwości już zdefiniowanych pierwiastków.
Historia układu okresowego
Stworzenie układu okresowego przypisuje się rosyjskiemu naukowcowi Dymitrowi Mendelejewowi, który w 1869 roku zebrał w tabeli wszystkie 63 pierwiastki znane dotychczas nauce.
Mendeleev ułożył pierwiastki w porządku rosnącym według ich mas atomowych, zwracając uwagę na to, aby w tej samej kolumnie umieścić te, których właściwości fizyczne są podobne. Zostawił nawet puste miejsca, przewidując istnienie innych, jeszcze wtedy nie odkrytych pierwiastków, które powinny być uwzględnione w tabeli.
Niedługo potem niemiecki chemik Julius Lothar Meyer uporządkował pierwiastki według fizycznych właściwości atomów. Wreszcie, ich obecną strukturę zawdzięczamy szwajcarskiemu naukowcowi Alfredowi Wernerowi.
Ostatnie duże zmiany w układzie okresowym są dziełem laureata nagrody Nobla w dziedzinie chemii Glenna Seaborga, który między innymi ułożył szereg aktynowców poniżej szeregu lantanowców.
Patrz również:
- Pierwiastek chemiczny.
- Symbol chemiczny.
Atom